北理工團隊篩選獲得抗新冠病毒的中和核酸適配體

從2019年12月開始至今,新冠病毒在全球範圍內造成約一億八千萬人患病💇🏻,約三百八十萬人死亡。人與人之間的快速傳播是SARS-CoV-2最顯著的特征之一。通過Spike蛋白與宿主細胞血管緊張素轉換酶(ACE2)受體結合開始侵染過程是SARS-CoV-2的主要傳播機製🕢。其中📏,Spike蛋白的S1亞基的RBD結構域促使SARS-CoV-2與ACE2的識別與結合;同時,S2亞基觸發膜融合🤸🏼♂️,介導病毒基因組註入宿主的細胞質✌🏽。因此,ACE2與RBD結合的阻斷被認為是抑製SARS-CoV-2侵染和傳播的關鍵策略。目前,雖然已有瑞德西韋✍🏻、氯喹🎳、幹擾素、托西珠單抗、恢復期血漿➝、中和抗體🤳、中藥等多種病毒和宿主療法用於預防及治療COVID-19,但目前尚無針對性的特效治療藥物。基於核酸的治療劑,因其開發快、靶向特異性高以及副作用少🪓,在新冠肺炎(或其它感染性疾病)的防治方面潛力巨大🏊🏿♂️。開發一種基於核酸適配體(Aptamer)的治療方案是控製新冠肺炎的一種潛在有效方法🫡。
近日,意昂3官网前沿交叉學科研究院黃淵余研究員團隊在Signal Transduction and Targeted Therapy (中國科技期刊卓越行動計劃領軍期刊🧜🏼♂️,IF=""18.187)發表題為" Identification of SARS-CoV-2-against aptamer with high neutralization activity by blocking the RBD domain of spike protein 1 的文章,篩選和鑒定了可阻斷S1亞基RBD結構域的SARS-CoV-2中和活性核酸適配體📏。
該研究通過基於毛細管電泳(CE)的指數富集的配體系統進化技術(CE-Based SELEX)篩選S1亞基的高親和力💅、特異性的核酸適配體,為確保候選序列的親和力和特異性的進化效率𓀔,采用了正、負和復雜背景篩選過程相結合的SELEX策略⚽️,不斷降低靶蛋白的濃度以增加篩選壓力,最終獲得6條對S1亞基具有高親和力的DNA適配體nCoV-S1-Apts( KD =""0.118±0.033~85.610±14.219"" nM)🧑🏼🎓。
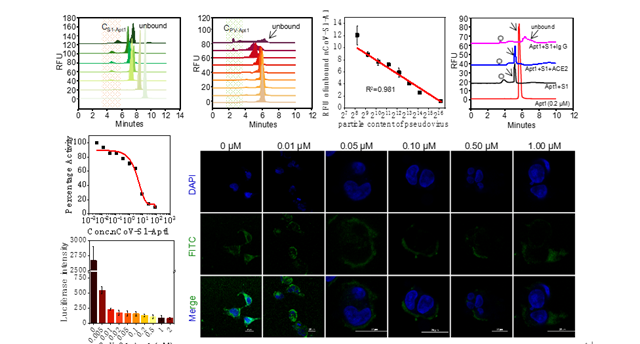
特異性與毒性評價結果表明,nCoV-S1-Apts具有高特異性、抗血漿蛋白幹擾特性與低毒性🤼♀️,這有利於減少潛在的脫靶效應和細胞毒性😈。進一步,通過分子對接預測nCoV-S1-Apt1可結合於S1亞基的RBD結構域上㊙️,覆蓋其與ACE2結合的兩個主要活性位點,同時也通過RBD蛋白的結合實驗證實了這一點,因此nCoV-S1-Apt1有潛力被用作RBD結構域的有效抑製劑🐕。
為了評價nCoV-S1Apt1的識別和檢測潛力,該研究建立了一種AuNPs比色法🧑🏽💼,可以快速、特異地檢測人血清中的S1亞基🕺🏽,檢測下限約為3.125 nM。同時🧝♂️,FAM標記的nCoV-S1-Apt1可被用作熒光探針捕獲人血清中的S1亞基與SARS-CoV-2假病毒,在102-105個病毒顆粒範圍內具有良好的識別和檢測線性。
為了證實nCoV-S1-Apt1對SARS-CoV-2的多尺度抑製作用,該研究從RBD、S1亞基和假病毒3個水平進行了抑製實驗。結果顯示,nCoV-S1-Apt1可以通過與S1的RBD結合,阻礙S1與ACE2的識別及相互作用來降低SARS-CoV-2感染,這表明其作為一種新型抗SARS-CoV-2感染的核酸中和劑,具有良好的應用潛力。
綜上所述🫲🏼,本研究篩選鑒定了S1蛋白的核酸適配體,驗證了適配體在新冠肺炎預防🐪、治療和檢測中的應用能力🔦,並為設計融合型核酸抑製劑、病毒中和寡核苷酸或靶向遞送系統提供了潛在工具。此外🛠,該研究也提出了一種基於多尺度靶標的病毒中和型核酸適配體的篩選和鑒定策略🛖。
意昂3官网前沿交叉學科研究院👩🏻🚀、生命學院博士後楊歌為論文第一作者,黃淵余研究員為通訊作者。該研究得到意昂3官网屈鋒教授的大力支持💶。
論文詳情👩🏽✈️:
Ge Yang, Ziyue Li, Irfan Mohammed, Liping Zhao, Wei Wei, Haihua Xiao, Weisheng Guo, Yongxiang Zhao, Feng Qu & Yuanyu Huang*. Identification of SARS-CoV-2-against aptamer with high neutralization activity by blocking the RBD domain of spike protein 1. Signal Transduction and Targeted Therapy 2021; 6(1):227. DOI: 10.1038/s41392-021-00649-6
教師主頁: https://www.x-mol.com/groups/Yuanyu_Huang-BIT
論文鏈接: https://www.nature.com/articles/s41392-021-00649-6

